اسیدها مواد شیمیایی هستند که با مزه ترش در محیط آبی مشخص می شوند.
بازها مواد شیمیایی هستند که با طعم تلخ مشخص می شوند. برخی ازبازها در آب قابل حل هستند در حالی که برخی دیگر در آن محلول نیستند.
بازهای محلول در آب به عنوان مواد قلیایی شناخته می شوند. آنها تمایل دارند که به رنگ آبی تیره تبدیل شوند.
اسیدها و بازها با طیف وسیعی از ترکیبات شیمیایی واکنش داده و نمک تشکیل می دهند.
برخی از واکنشهای شیمیایی این دو ماده عبارتند از:
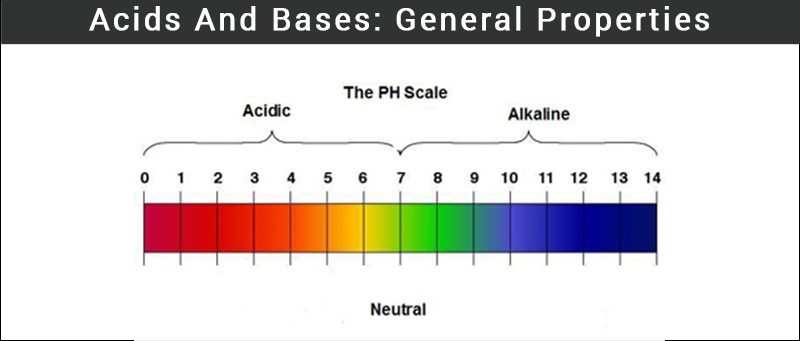
خواص اسید ها و بازها
خصوصیات اسید ها
- اسیدهای معدنی مایعات بی رنگ هستند اما گاهی اوقات اسید سولفوریک به دلیل ناخالصی ها زرد می شود. برخی از اسیدهای آلی جامداتی به رنگ سفید هستند.
برای مثال بنزوئیک اسید
- مزهای ترش دارند. لیمو، سرکه و حتی آبنباتهای ترش شامل این ماده می باشند.
- محلول در آب است.
خصوصیات بازها
کاربرد اسید ها
- ممکن است برای نگهداری شیر استفاده شود.
- اسید سولفوریک معمولاً در باتری ها یافت می شود. باتری های مورد استفاده برای تأمین انرژی موتورهای خودرو معمولاً این اسید را تولید می کنند
- فرآوری مواد منفجره، رنگها و کودها نیاز به استفاده از اسید سولفوریک ونیتریک دارد.
ابتدا به خواص شیمیایی اسیدها می پردازیم:
- اسیدها رنگ شناساگر را از آبی به قرمز تغییر می دهند.
- آنها رنگ متیل اورانژ(Methyle Orange) را از نارنجی / زرد به صورتی تبدیل می کنند.
- اسیدها می توانند الکتریسیته را هدایت کنند.
- برخی از اسیدها از نظر ماهیت بسیار خورنده هستند. و این بدان معناست که باعث خوردگی یا زنگ زدگی فلزات می شوند.
- در حالی که با یک فلز فعال مانند روی ، منیزیم و غیره واکنش نشان می دهند .تمایل به تکامل گاز هیدروژن دارند.
- آنها وقتی با آب مخلوط می شوند یون های H + تولید می کنند.
- با مخلوط شدن با یک باز اسیدیته خود را از دست می دهند.
- وقتی مقدار مساوی اسید و باز با هم ترکیب شوند ، فرآیند خنثی سازی رخ می دهد و نمک و آب تشکیل می شود .
- مقدار pH اسید از 0-6 است.

شناسایی اسیدها و بازها
- از نظر طعم ترش هستند.
- اسیدها با کربناتها و کربناتهای هیدروژن واکنش می دهند و یک گاز نمک ، آب و دی اکسید کربن تشکیل می دهند.
- فلزات بسیار فعال مانند پتاسیم ، کلسیم ، سدیم و… وقتی با اسیدها ترکیب می شوند منفجر می شوند.
- اسیدهای ضعیف مانند اسید کربنیک به هیچ وجه با هیچ فلزی عمل نمی کنند.
- اسیدهای نیتریک معمولاً خاصیت اسیدی از خود نشان نمی دهند ، در عوض خاصیت اکسید کنندگی دارند.
- فلزاتی که به طور کلی با اسید رقیق واکنش می دهند و نمک و هیدروژن تشکیل می دهند. فلزاتی هستند که بالاتر از هیدروژن در سری فعالیت های فلز قرار دارند.
- هنگام واکنش با سولفیت ها و بی سولفیت ها ، یک نمک ، آب و دی اکسید گوگرد تشکیل می دهند.
- اسیدها و سولفیدهای فلزی نمک و سولفید هیدروژن تشکیل می دهند. آنها بر اساس منابع ، قدرت ، غلظت ، وجود اکسیژن و پایه بودن آن طبقه بندی می شوند.
-
بسیاری از اسیدها در صورت بلعیدن خطرناک هستند و نباید آنها را چشید.
-
به محض اتصال به یک ماده خنثی تبدیل می شود.
-
اغلب این واکنش می تواند منجر به آب و نمک شود. این امر اغلب هنگامی مشاهده می شود که اسیدهای قوی با بازهای قوی واکنش نشان می دهند
-
ماده ای که الکتریسیته را به شدت هدایت می کند یک اسید قوی است و ماده ای که الکتریسیته را ضعیف هدایت می کند یک اسید ضعیف است.
انواع مختلف اسیدها
- آلی
- معدنی
- قوی
- ضعیف
- غلیظ
- رقیق
- مونوبازیک
- دیابازیک
- تریابازیک
اکنون به بررسی خواص شیمیایی بازها می پردازیم :
- رنگ شناساگر را از قرمز به آبی تغییر می دهند.
- آنها از نظر طعم تلخ هستند.
- بازها وقتی با اسیدها مخلوط می شوند خاصیت بازی خود را از دست می دهند.
- باز با اسید واکنش داده و نمک و آب تشکیل می دهند. این فرآیند واکنش خنثی سازی نامیده می شود.
- آنها می توانند برق را هدایت کنند.
- بازها لغزنده یا صابونی هستند.
- برخی از بازها رساناهای عالی برق هستند.
- ازبازهایی مانند هیدروکسید سدیم ، هیدروکسید پتاسیم و… به عنوان الکترولیت استفاده می شود.
- قلیاها بازهایی هستند که وقتی با آب مخلوط می شوند یون های هیدروکسیل (OH-) تولید می کنند.
- مواد قلیایی قوی از نظر خوراکی بسیار خورنده هستند در حالی که سایر مواد قلیایی خورنده ملایمی هستند.
- مقدار pH بازها بین 8-14 است.
- قلیاها و نمکهای آمونیوم آمونیاک تولید می کنند.
- گاز هیدروژن هنگامی تکامل می یابد که فلزات با یک باز واکنش نشان دهند.
- بازها بر اساس مقاومت ، غلظت و اسیدیته طبقه بندی می شوند.
- انواع مختلف اسیدها عبارتند از: اسید باز قوی ، اسید باز ضعیف ، باز غلیظ ، باز رقیق ، باز مونو اسیدی ، باز دی اسید و باز تریاسید.

 حلال های شیمیایی آزمایشگاهی
حلال های شیمیایی آزمایشگاهی پودرهای شیمیایی آزمایشگاهی
پودرهای شیمیایی آزمایشگاهی تجهیزات آزمایشگاهی
تجهیزات آزمایشگاهی



1 دیدگاه در “اسید و باز و خواص آن ها”